Science:华人团队揭示溶酶体驱动的长寿的跨代遗传机制,一作将回国加入浙江大学
来源:生物世界 2025-10-14 10:59
在这项新研究中,研究团队发现,在秀丽隐杆线虫中,溶酶体代谢通路通过表观基因组信号转导来调控跨代寿命。
在一些模式生物(秀丽隐杆线虫、小鼠)中,饥饿会延长寿命,进而延长它们后代的寿命。贝勒医学院王萌团队此前研究发现,溶酶体中的一种脂肪酶 LIPL-4,在这一过程中发挥了关键作用——饥饿会迅速激活 LIPL-4,而过表达 LIPL-4 能够显著延长线虫寿命,令人惊讶的是,这些长寿线虫的后代,即便自身没有这种基因改变(过表达 LIPL-4),其寿命也比正常线虫更长。而且,当这些长寿线虫与没有基因改变的野生型线虫杂交时,其杂交后代的寿命也比正常线虫长。
基于上述发现,王萌团队推测,这种长寿标志物可能以某种方式在代际间传递。
近日,贝勒医学院王萌教授团队(博士后张庆昊为第一作者)在国际顶尖学术期刊 Science 上发表了题为:Lysosomes signal through the epigenome to regulate longevity across generations 的研究论文。论文一作张庆昊即将回国加入浙江大学基础医学院。
该研究揭示了父母的溶酶体发生的促进长寿的变化是如何传递给后代的——溶酶体代谢信号通过组蛋白 H3.3 变体和 H3K79 组蛋白甲基化修饰组成的表观遗传调控机制,在不改变 DNA 序列的情况下,实现溶酶体驱动的长寿的跨代遗传。
论文通讯作者王萌教授表示,我们总是认为遗传物质在细胞内的细胞核中,但这项新研究证明了,组蛋白可以从一个地方移动到另一个地方,如果这个组蛋白带有任何修饰,那就意味着它将表观遗传信息从一个细胞(肠道细胞)传递到另一个细胞(生殖细胞)。这为理解跨代遗传效应提供了一种新机制。

在这项新研究中,研究团队发现,在秀丽隐杆线虫中,溶酶体代谢通路通过表观基因组信号转导来调控跨代寿命。激活溶酶体脂质信号转导和溶酶体腺苷酸活化蛋白激酶(AMPK),或抑制溶酶体雷帕霉素靶蛋白(mTOR)信号转导,可增加组蛋白 H3.3 变体(HIS-71)的表达,并促进其 K79 位点的甲基化修饰,从而实现多代寿命的延长。
这种跨代延长寿命效应需要组蛋白 H3.3 变体从肠道向生殖细胞的转运,以及生殖细胞特异性 H3K79 甲基转移酶的参与。通过过表达 H3.3 或 H3K79 甲基转移酶,可重现这一效应。因此,溶酶体产生的信号通过影响表观基因组,将体细胞与生殖细胞联系起来,介导了寿命的跨代遗传。
具体而言,研究团队发现,与正常寿命的线虫相比,寿命更长的线虫体内有一种特定的组蛋白修饰水平升高。然后,他们利用包括转录组学和成像技术在内的多种工具,发现饥饿期间被激活的溶酶体代谢的变化,会引发细胞内一系列过程,从而导致一种特定组蛋白变体——H3.3 的增加。这种组蛋白随后从肠道被转运到生殖细胞,在那里它会以一种方式被修饰(H3K79甲基化修饰),使得溶酶体信息能够进入生殖细胞系,并从亲代传递给子代,在不改变 DNA 序列的情况下,实现溶酶体驱动的长寿的跨代遗传。
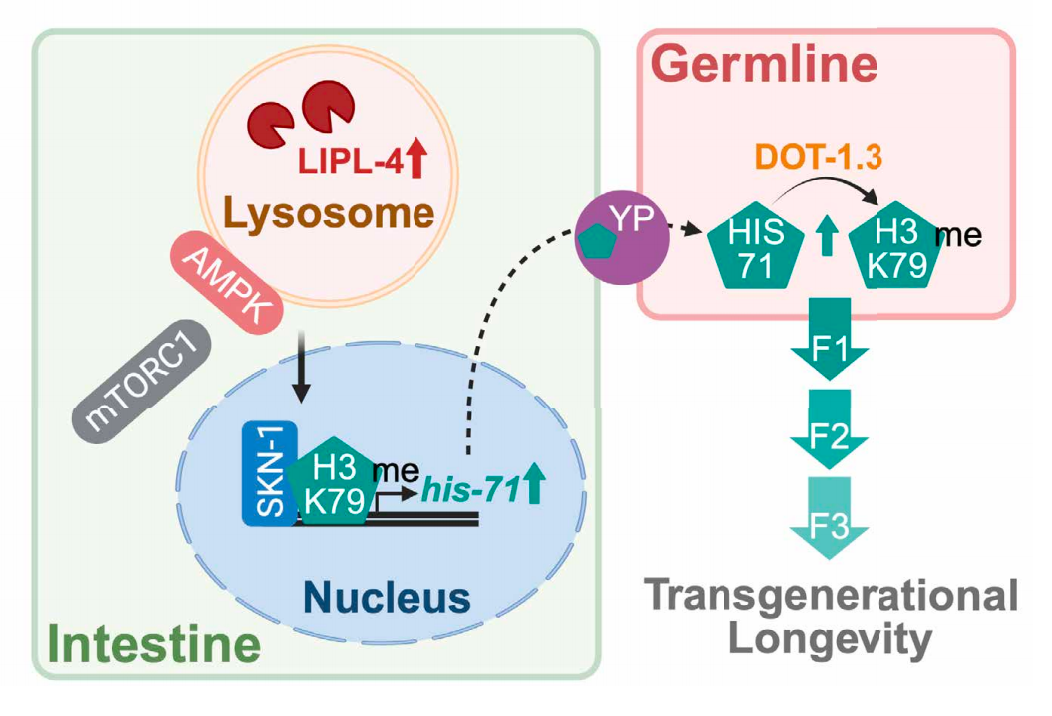
总的来说,这些研究表明,在模式生物秀丽隐杆线虫中,溶酶体脂肪酶 LIPL-4 活性增强(过表达 LIPL-4,或通过饥饿诱导),会激活肠道溶酶体信号转导通路,这一过程促使组蛋白 H3.3 变体的转录和合成增加,这种组蛋白能够从肠道细胞转移至生殖细胞,并在生殖细胞内经甲基转移酶修饰后遗传给后代,这种表观遗传修饰最终导致了后代寿命延长。
这些发现不仅阐释了寿命的跨代遗传机制,还有助于理解亲代营养不良、环境应激等表观遗传信息在代际间传递的生物学基础。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。

